Goodpasture综合征为病因不明的过敏性疾病,血内有循环抗肾小球基底膜抗体及免疫球蛋白和补体呈线样沉积于肾小球基膜,造成肺出血伴严重进展性发展的肾小球肾炎为特点。
goodpasture综合征病因
免疫荧光染色显示在肾小球基膜和一些病人的肺泡-毛细血管基膜内有免疫球蛋白和补体沉积。
在肺和肾脏,抗肾小球基底膜抗体的主要靶位是Ⅳ基底膜胶原2,3链的非胶原(NC-1)性功能区。感染、吸烟和吸入损伤被认为是通过这些抗体造成毛细血管损伤,遗传也起一定作用,HLA-DRW2与抗肾小球基底膜疾病相关。
goodpasture综合征临床表现
发病前部分患者有呼吸道感染,以后有反复咯血,大多数出现在肾脏病变之前,长者数年(最长可达12年),短者数月,少数则在肾炎后发生。在咯血时肺弥散功能减退,出现低氧血症,贫血常见。肾脏表现:每例均有蛋白尿、红细胞及管型,可有肉眼血尿。肾功能减退,然而进展速度不一,有的患者可在1~2日内呈现急性肾功能衰竭,大多数在数周至数月内发展至尿毒症,少数演变较慢,有稳定在原水平或缓解以后又复发者。
goodpasture综合征检查
1.一般检查
通常应包括血常规,血液生化,肾功能动脉血气分析,尿常规等。
2.血清学检查
初选试验可包括抗核抗体(ANA)谱,抗双链(ds)DNA,抗中性粒细胞胞浆抗体(ANCA)抗基底膜(GBM)抗体和抗磷脂抗体。SLE患者可有高滴度ANA和dsDNA,而补体水平降低Goodpasture综合征的循环抗GBM抗体阳性。ANCA包括核周型(P-ANCA)和细胞浆型两种,前者为针对髓过氧化物酶(MPO)弹力酶和乳铁蛋白的抗体,后者针对的抗原为分布在细胞浆的丝氨酸蛋白3(PR3),即C-ANCA显微镜下多动脉炎、Churg-Strauss血管炎和寡免疫性肾小球肾炎(PIGN)可出现P-ANCA阳性。
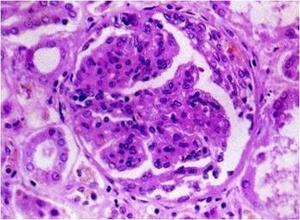
3.肾活检
除了常规光镜检查外,通常需要进行直接免疫荧光染色。免疫介导的肺泡出血综合征同时有肾受累时则肾病理为坏死性肾小球肾炎,组织学改变的程度不同,从轻的系膜增厚至严重的新月体性肾小球肾炎肾动脉血管炎则很少。各种疾病的免疫荧光染色有不同表现,抗基底膜抗体(ABMA)病沿肾小球基底膜有线样沉积胶原血管病及特发性免疫复合物介导的肾小球肾炎呈颗粒状沉积,而PIGN的免疫荧光检测为阴性,联合血清学ANCA、ABMA、ANA等检测能够提高对诊断、治疗和预后的判断意义。
4.气管镜检查
气管镜和肺泡灌洗(BAL)检查有助确诊肺泡出血,排除感染和气道局部病变引起的出血从而帮助鉴别诊断和寻找病因。显微镜检查发现含铁血黄素细胞也具有肯定肺泡出血的价值。
5.肺活检
经支气管肺活检对于DAH的诊断价值有限,为明确病因需开胸肺活检。肺活检仅适用于经常规检查仍未明确病因且病情相对稳定,能够耐受单侧肺萎陷的患者。严重肺出血和呼衰病人不适宜开胸肺活检肺活检术后可伴发感染和气胸。
goodpasture综合征鉴别诊断
可引起肺的出血的疾病很多都需要仔细与Goodpasture综合征鉴别,方可能给予有效治疗。如晚期肾衰竭患者合并肺的出血的原因可能为凝血障碍另一方面,某些疾病的早期也可能发生肺出血。引起肺出血常见病因依次为血管炎,包括韦氏肉芽肿和系统性坏死性血管炎;抗肾小球基底膜抗体(AGBM)疾病;胶原血管疾病;IgA肾病(IgAN);未归类肺肾综合征和IPH等。
goodpasture综合征并发症
最常见的并发症是溶血尿毒综合征肺的出血,可致呼吸衰竭、窒息等。
goodpasture综合征治疗
在急性期常需气管插管,辅助通气和血透。随后的处理依赖于大剂量皮质类固醇的使用(甲基强的松龙),免疫抑制剂环磷酰胺及反复血透排除循环中抗肾小球基膜抗体。免疫抑制治疗的疗程变动较大,在某些病人则可能需要12~18个月。早期综合使用这些措施可保护肾功能,晚期肾疾病可行长期血透或肾移植。
1.强化血浆置换疗法每次置换2升,每日或隔日1次。配合泼尼松,环磷酰胺治疗。
2.甲基泼尼松龙冲击疗法。辅以泼尼松及环磷酰胺口服。
3.透析治疗及肾移植急性肾功能衰竭符合透析指征时及时透析,晚期予维持透析或肾移植。